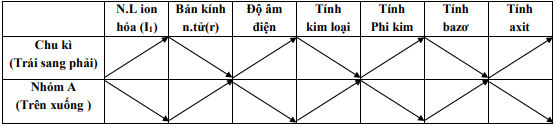
I. Sự biến đổi tính kim loại, tính phi kim
1. Tính kim loại, tính phi kim
– Tính kim loại
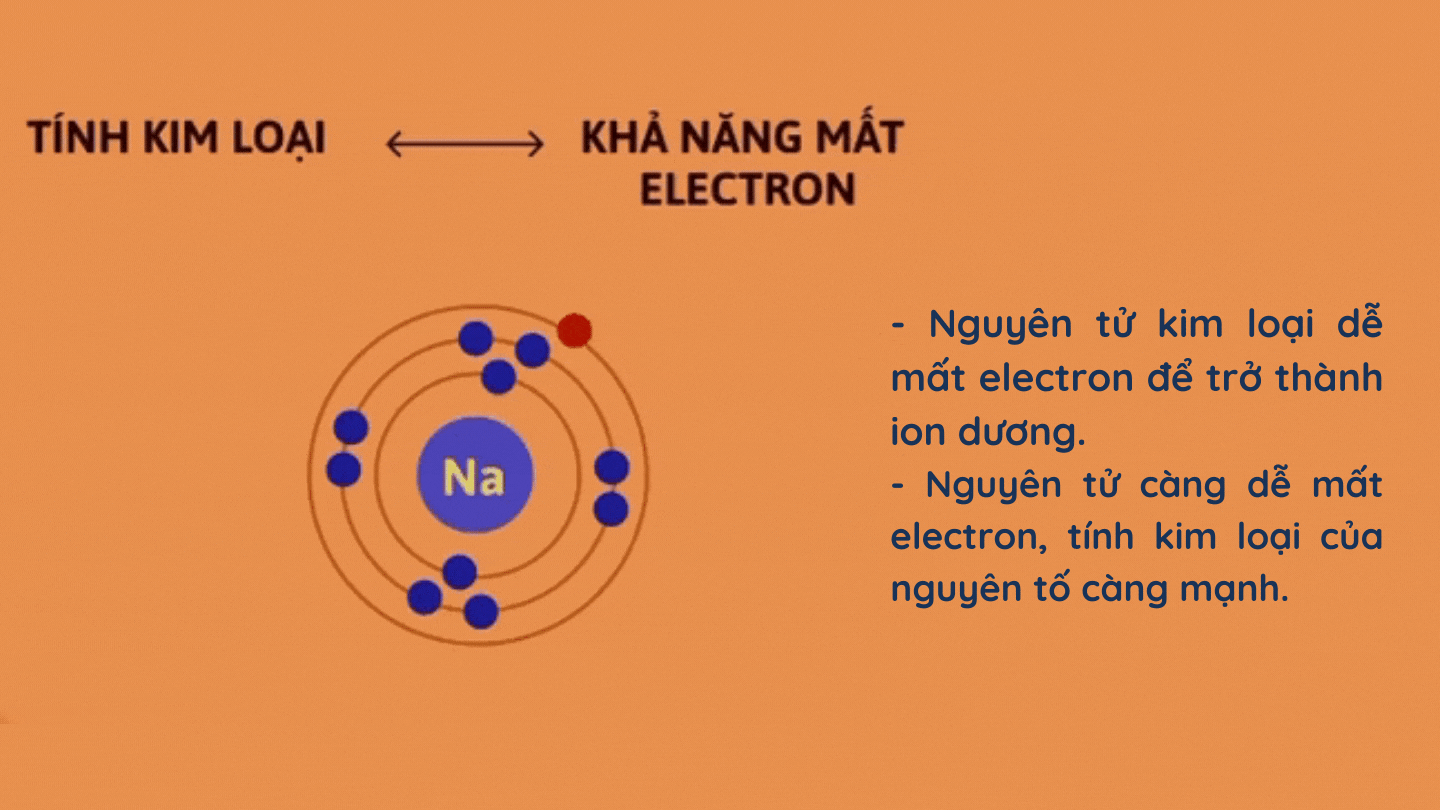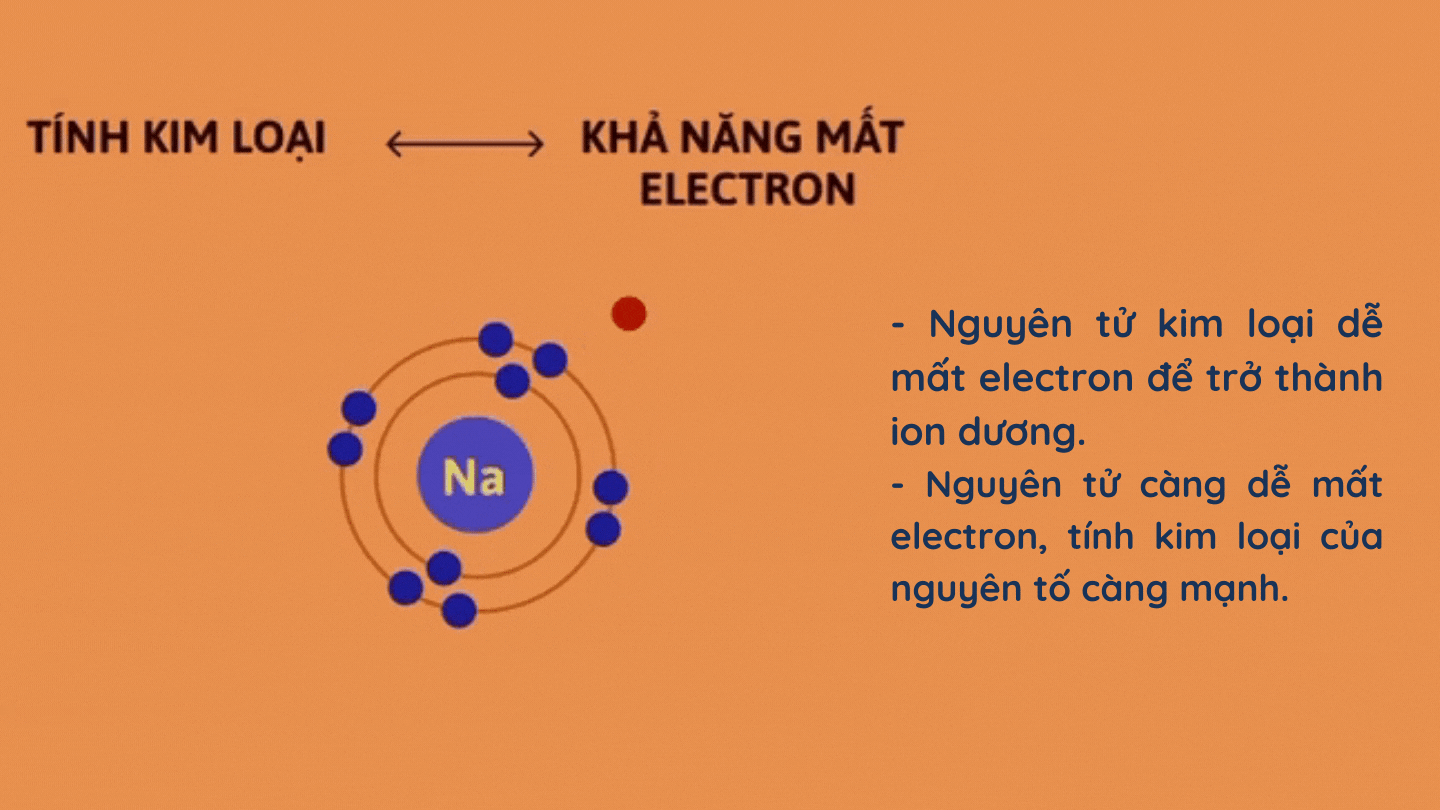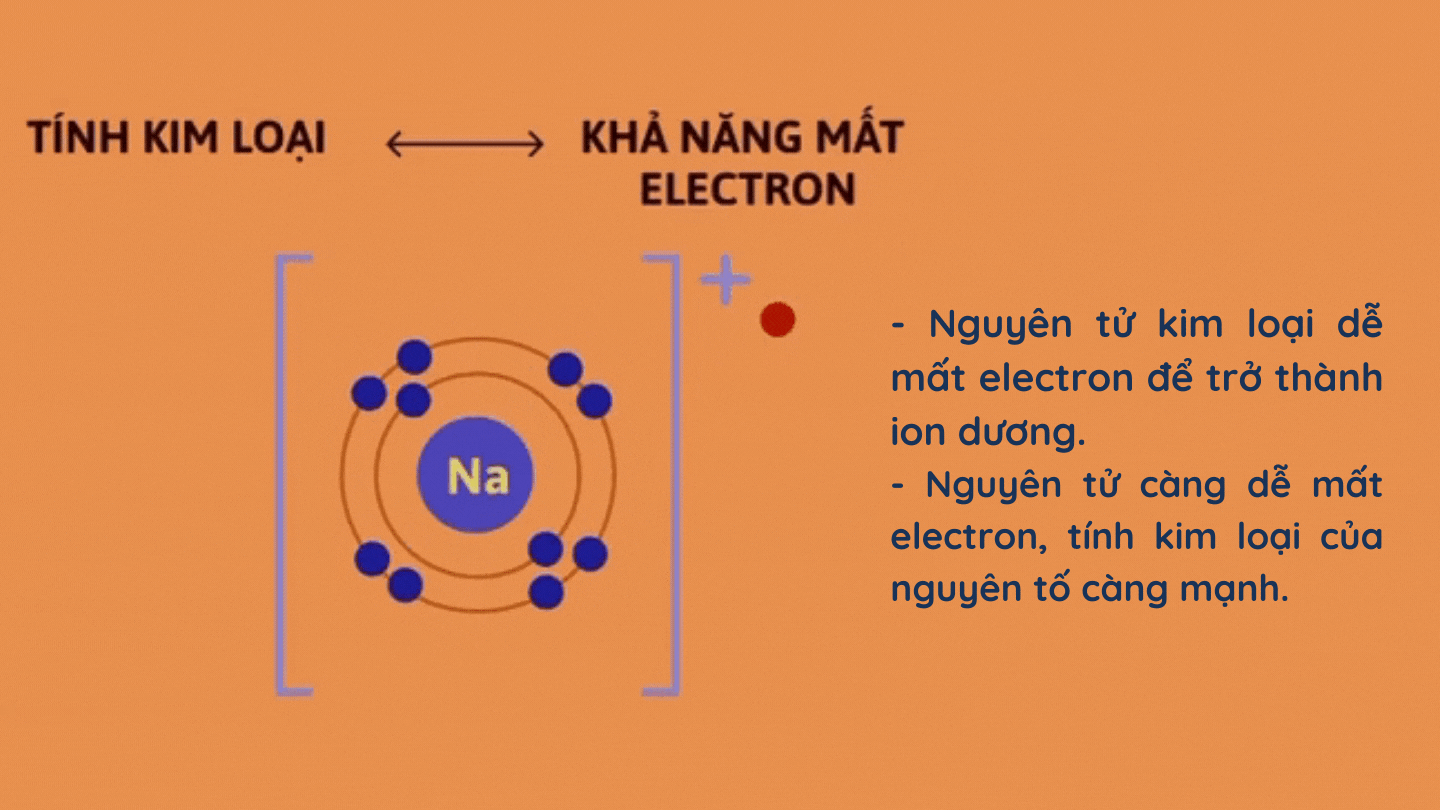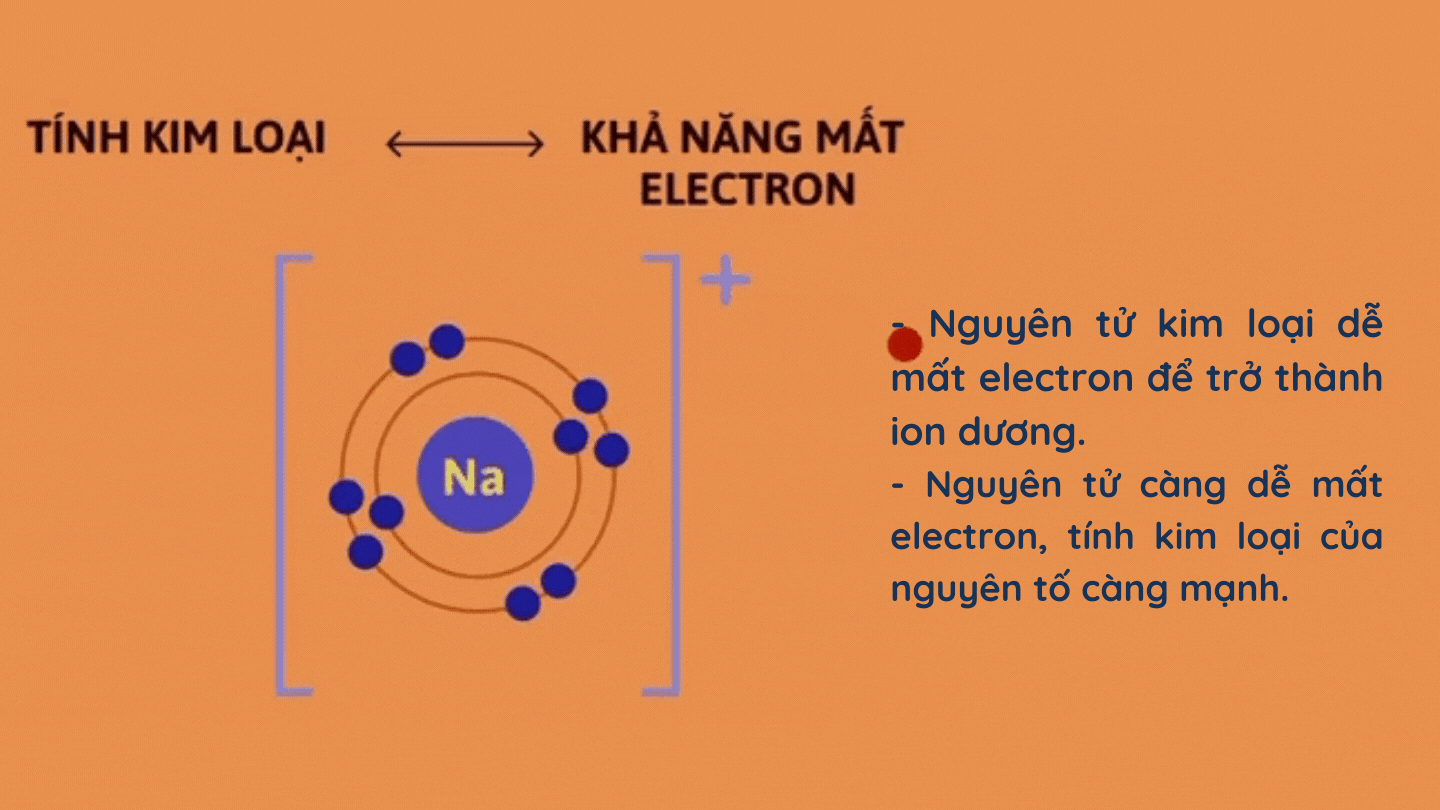
– Tính phi kim
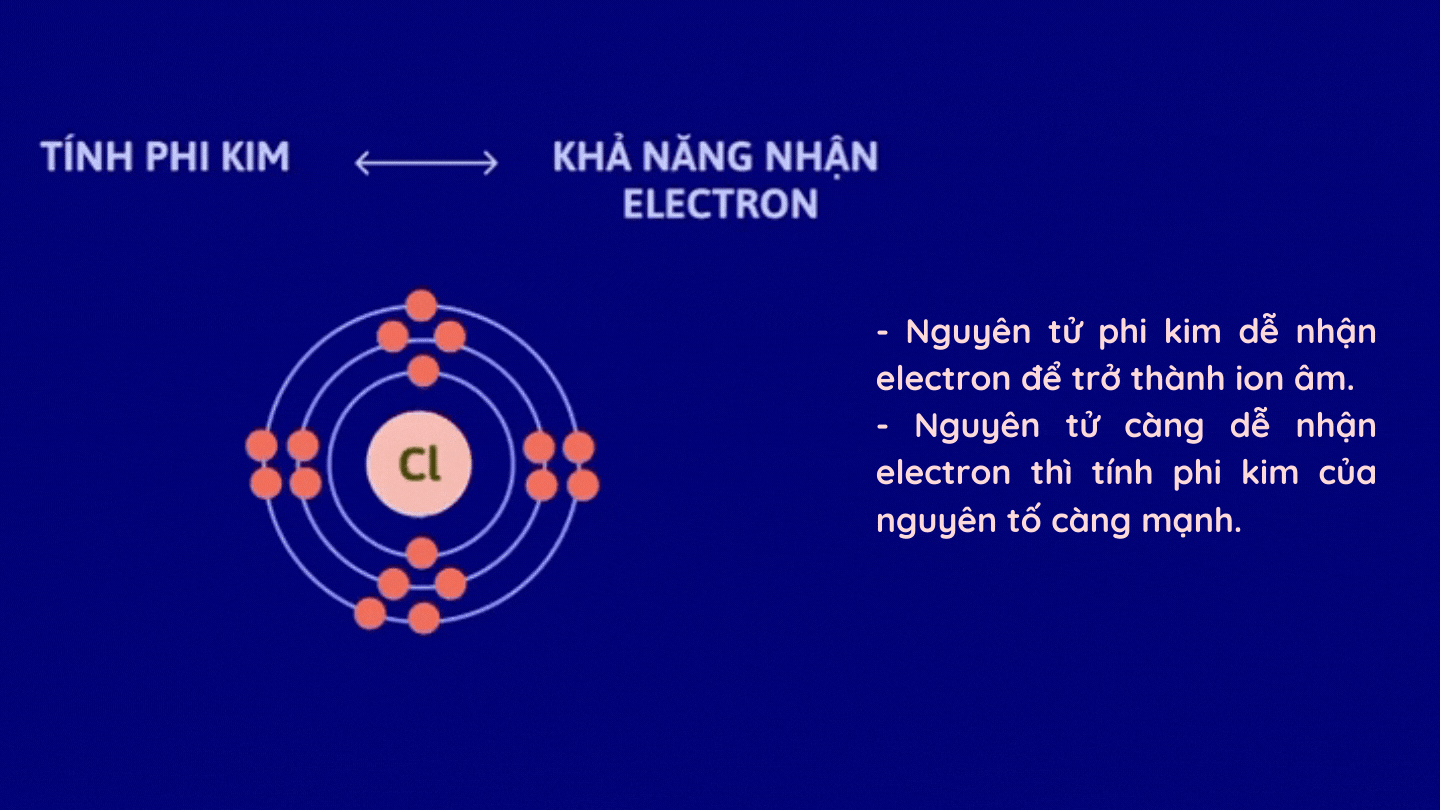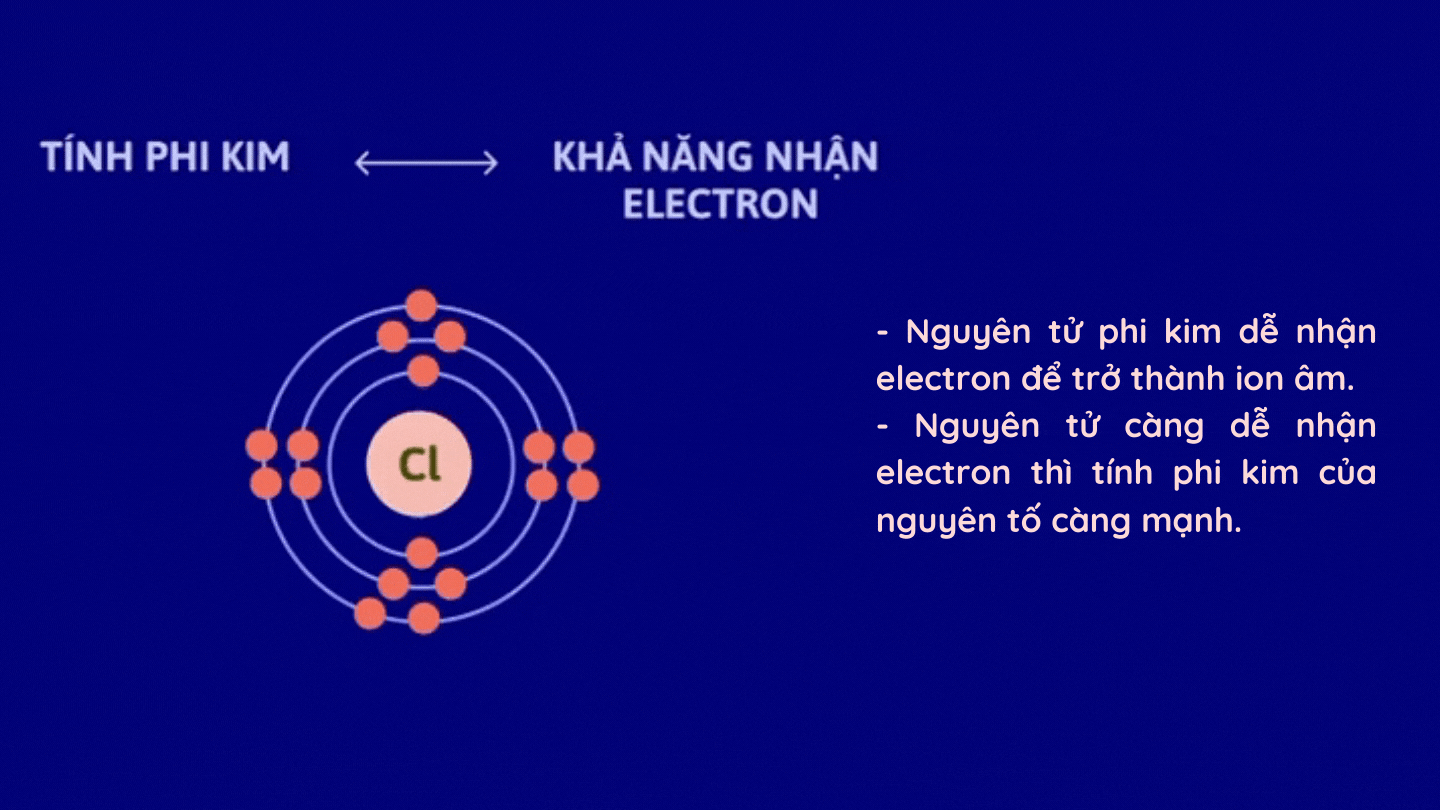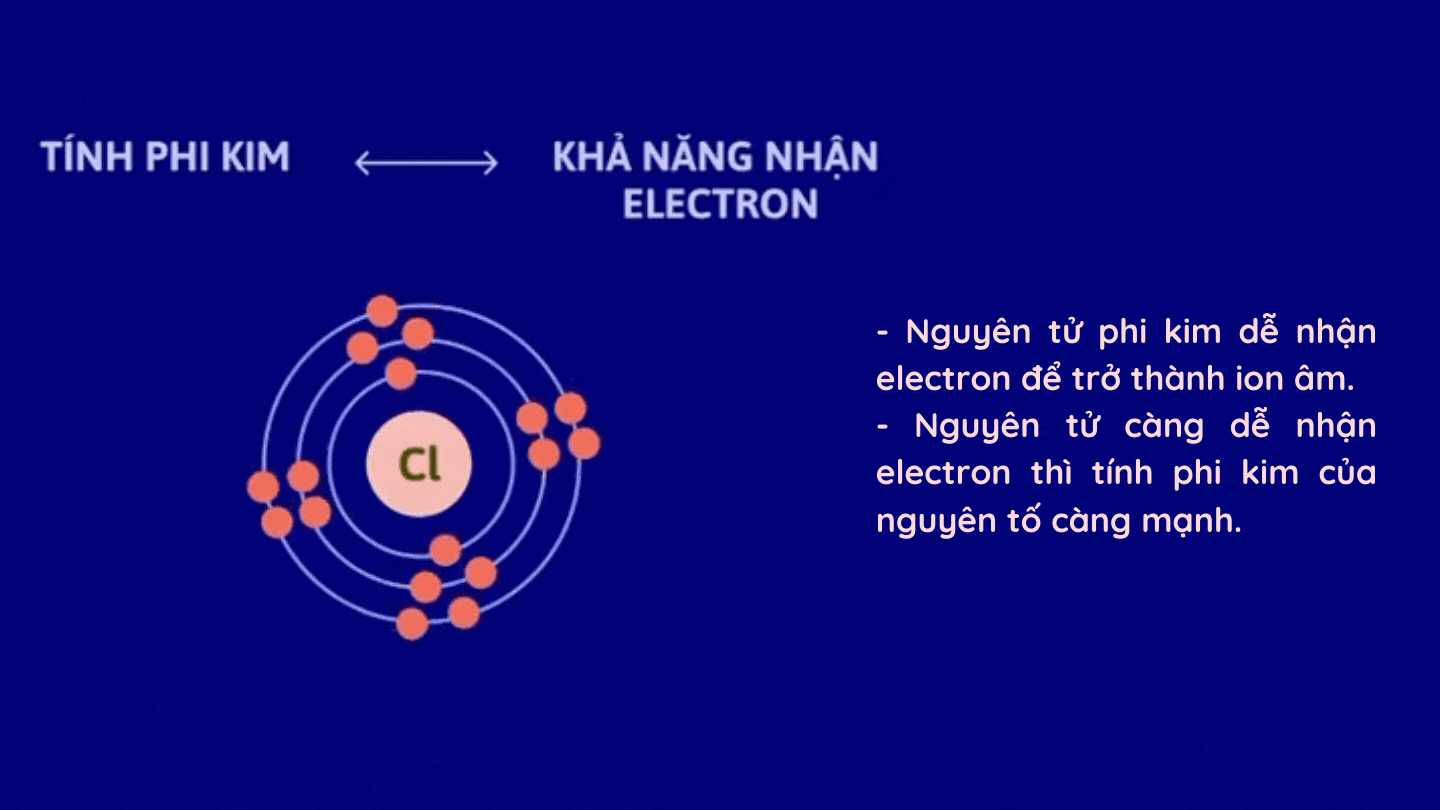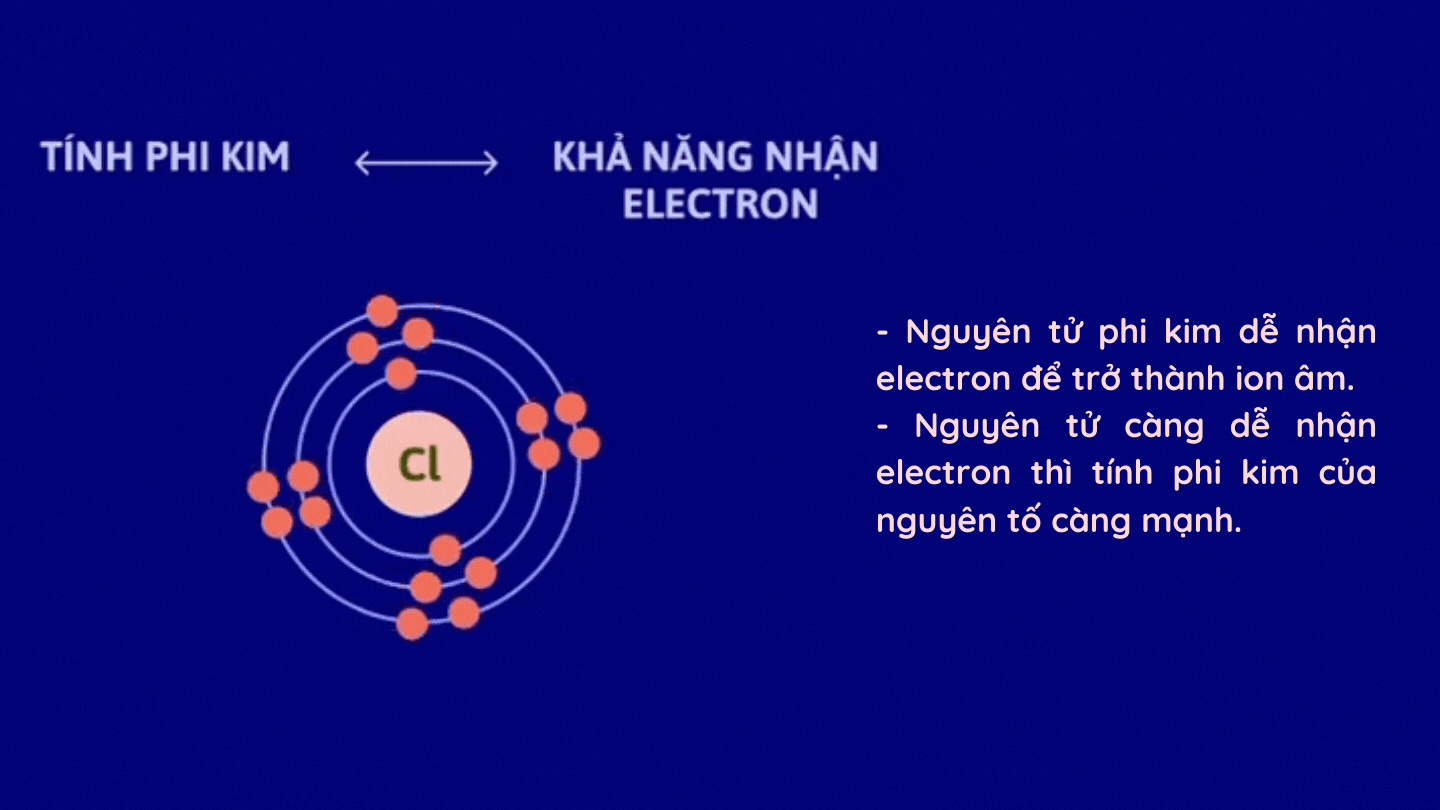
2. Sự biến đổi tính kim loại, tính phi kim
– Trong mỗi chu kì, theo chiều tăng của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần.
Giải thích: trong một chu kì, theo chiều tăng của điện tích hạt nhân (từ trái sang phải) thì độ âm điện tăng dần đồng thời bán kính nguyên tử giảm dần => khả năng nhường electron giảm, khả năng nhận electron tăng
=> Tính kim loại giảm, tính phi kim tăng.
– Trong một nhóm A, theo chiều tăng của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần.
Giải thích: Trong một nhóm A, theo chiều tăng của điện tích hạt nhân (từ trên xuống dưới) thì độ âm điện giảm dần đồng thời bán kính nguyên tử tăng nhanh => khả năng nhường electron tăng, khả năng nhận electron giảm
=> Tính kim loại tăng, nên tính phi kim giảm.
Ví dụ: Dãy nguyên tố được sắp xếp theo chiều tăng dần tính kim loại từ trái sang phải
Na < K < Mg < Al.
Al < Mg < Na < K.
Mg < Al < Na < K.
K < Na < Al < Mg.
Lời giải:
Na, Mg và Al là 3 kim loại thuộc cùng chu kì 2, vì ZNa < ZMg < ZAl => thứ tự tính kim loại tăng dần là: Al < Mg < Na
K thuộc chu kì 3 => bán kính nguyên tử của K lớn nhất
=> thứ tự tăng dần tính kim loại từ trái sang phải là: Al < Mg < Na < K.
=> Đáp án: B
II. Sự biến đổi tính acid – base của oxide và hydroxide tương ứng
– Tính acid – base của oxide và hydroxide tương ứng của các nguyên tố ở chu kì 3
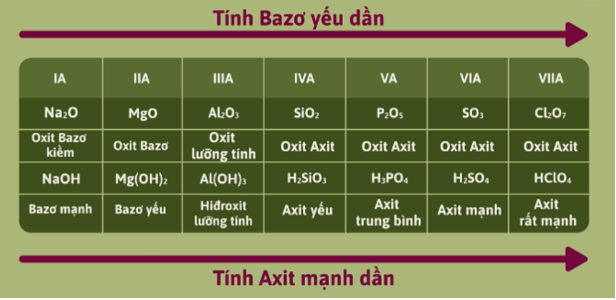
– Trong một chu kì, theo chiều tăng của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
– Trong một nhóm A, theo chiều tăng của điện tích hạt nhân, tính base của các oxide và hydroxide tương ứng tăng dần, đồng thời tính acid của chúng giảm dần.
Nhận xét: Tính acid – base của các oxide và hydroxide tương ứng của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
III. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.