1. Giải bài 23.1 trang 52 SBT Hóa học 12
Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3 và MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm
A. Cu, Al, Mg.
B. Cu, Al, MgO.
C. Cu, Al2O3, Mg.
D. Cu, Al2O3, MgO.
Phương pháp giải
Để chọn đáp án đúng cần ghi nhớ CO khử được các oxit kim loại sau nhôm.
Hướng dẫn giải
CO khử được CuO
=> Chọn D
2. Giải bài 23.2 trang 52 SBT Hóa học 12
Hòa tan 28 g Fe vào dung dịch AgNO3 dư đến khi phản ứng hoàn toàn thì khối lượng chất rắn thu được là
A.108g. B. 162 g.
C. 216 g. D. 154 g.
Phương pháp giải
– Viết phương trình hóa học của phản ứng.
– Tính toán số mol các chất theo phương trình hóa học.
Hướng dẫn giải
nFe = 0,5 mol
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
0,5 0,5 1
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
nFe(NO3)3 = 0,5 mol = nAg
mAg = 1,5.108 = 162 gam.
Chọn B.
3. Giải bài 23.3 trang 53 SBT Hóa học 12
Điện phân 400 ml dung dịch CuSO4 0,2M với cường độ dòng điện 10A trong một thời gian thu được 0,224 lít khí (đktc) ở anot. Biết điện cực đã dùng là điện cực trơ và hiệu suất điện phân là 100%. Khối lượng catot tăng là
A. 1,28 g. B. 0,32 g.
C. 0,64 g. D. 3,2 g.
Phương pháp giải
– Tính số mol khí anot => Số mol Cu sinh ra
– Khối lượng catot tăng là khối lượng Cu thu được
Hướng dẫn giải
nCuSO4 = 0,08 mol (1)
2H2O → 4H+ + O2 + 4e
nO2 = 0,01 mol
ne anot = ne catot = 4nO2 = 0,04 mol (2)
Từ (1), (2) đồng chưa điện phân hết.
ne catot = 2nCu = 0,02 mol
mCu = 1,28 gam.
Chọn A.
4. Giải bài 23.4 trang 53 SBT Hóa học 12
Cuốn một sợi dây thép vào một thanh kim loại rồi nhúng vào dung dịch H2SO4 loãng. Quan sát thấy bọt khí thoát ra rất nhanh từ sợi dây thép. Thanh kim loại đã dùng có thể là
A. Cu. B. Ni.
C. Zn. D. Pt.
Phương pháp giải
Dựa vào lí thuyết bài tính chất của kim loại, dãy điện hóa kim loại để xác định thanh kim loại đã dùng.
Hướng dẫn giải
Các cặp Fe và Pb, Fe và Sn, Fe và Ni. Sắt hoạt động hơn nên sẽ đóng vai trò là cực âm, bị phá huỷ trước
=>Chọn C.
5. Giải bài 23.5 trang 53 SBT Hóa học 12
Ngâm một lá Zn vào dung dịch HCl thấy bọt khí thoát ra ít và chậm. Nếu nhỏ thêm vào vài giọt dung dịch X thì thấy bọt khí thoát ra rất nhiều và nhanh. Chất tan trong dung dịch X là
A. H2SO4. B. FeSO4.
C. NaOH. D. MgSO4.
Phương pháp giải
Dựa vào lí thuyết bài tính chất của kim loại, dãy điện hóa kim loại, quá trình trong thí nghiệm trên và điều kiện xuất hiện pin điện hóa để xác định chất tan trong dung dịch X.
Hướng dẫn giải
Khi cho FeSO4 vào dung dịch X xuất hiện pin điện hóa Fe – Zn và giảm sự tiếp xúc của hiđro trên bề mặt kim loại làm Zn ăn mòn nhanh hơn => khí thoát ra nhanh hơn
=> Chọn B
6. Giải bài 23.6 trang 53 SBT Hóa học 12
Cắm 2 lá kim loại Zn và Cu nối với nhau bằng một sợi dây dẫn vào cốc thuỷ tinh. Rót dung dịch H2S04 loãng vào cốc thuỷ tinh đó thấy khí H2 thoát ra từ lá Cu. Giải thích nào sau đây không đúng với thí nghiệm trên ?
A. Cu đã tác dụng với H2SO4 sinh ra H2.
B. Ở cực dương xảy ra sự khử H+: 2H++ 2e —> H2 .
C. Ở cực âm xảy ra sự oxi hoá Zn : Zn —> Zn2+ + 2e.
D. Zn bị ăn mòn điện hoá và sinh ra dòng điện.
Phương pháp giải
Cần nắm rõ quá trình xảy ra pin điện hóa trong quá trình trên và cần ghi nhớ kim loại sau H trong dãy điện hóa không tác dụng với axit sunfuric loãng.
Hướng dẫn giải
Kim loại sau H trong dãy điện hóa không tác dụng với axit sunfuric loãng.
=> Chọn A.
7. Giải bài 23.7 trang 53 SBT Hóa học 12
Để các hợp kim: Cu-Fe(1); Fe-C(2); Fe-Zn(3) trong không khí ẩm. Hợp kim trong đó sắt bị ăn mòn là
A. (1), (2). B. (2),(3).
C. (1),(3). D. (1),(2),(3)
Phương pháp giải
Dựa vào bản chất quá trình xảy ra pin điện hóa tính kim loại của các kim loại trên để trong các hợp kim đã cho trong đó sắt bị ăn mòn.
Hướng dẫn giải
Tính kim loại Zn>Fe>Cu. Kim loại mạnh hơn sẽ bị ăn mòn trước => Fe-Cu thì sất bị ăn mòn trước
Fe-C trong đó sắt bị ăn mòn trước do
Cực âm Fe → Fe2+ +2e
Cực dương O2 + 2H2O + 4e → 4OH−
=> Chọn A
8. Giải bài 23.8 trang 53 SBT Hóa học 12
Trình bày phương pháp hoá học để có thể tách riêng từng kim loại ra khỏi một dung dịch có chứa các muối :
a) FeSO4 và CuSO4.
b) NaCl và CuCl2.
Phương pháp giải
a) Cho sắt vào dung dịch thu được Cu sau đó thu được dung dịch FeSO4 => đưa về Fe2O3 => dùng CO khử
b) Dùng NaOH => thu được dd NaCl điện phân nóng chảy thu được Na. Nung kết tủa Cu(OH)2 => CuO dùng CO khử.
Hướng dẫn giải
a)
\(FeS{O_4},C{\text{uS}}{O_4}\xrightarrow{{ + Fe}}Cu,\,FeS{O_4}\)
\(FeS{O_4}\xrightarrow{{NaOH}}Fe{(OH)_2} \to Fe{(OH)_3}\)
\(Fe{(OH)_3}\xrightarrow{{{t^o}}}F{e_2}{O_3}\xrightarrow{{ + CO}}Fe\)
b)
\(NaCl,CuC{l_2}\xrightarrow{{NaOH}}NaCl,Cu{(OH)_2}\)
\(NaCl\xrightarrow{{dpnc}}Na + C{l_2}\)
\(Cu{(OH)_2}\xrightarrow{{{t^o}}}CuO\xrightarrow{{{H_2}}}Cu\)
9. Giải bài 23.9 trang 53 SBT Hóa học 12
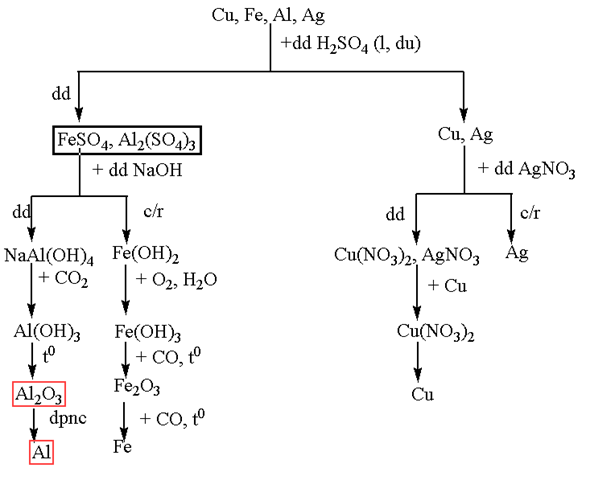
Trình bày sơ đồ tách riêng từng kim loại từ hỗn hợp các kim loại : Cu, Fe, Al, Ag.
Phương pháp giải
– Dùng H2SO4 tách Fe, Al, và Cu, Ag thu được dung dịch X
– Dùng AgNO3 để tách Ag => Thêm Cu vào dung dịch thu được để thu được Cu(NO3)2 sau đó điện phân dung dịch
– Dùng NaOH dư vào dung dịch X thu được chất rắn Fe(OH)2 và dung dịch Y
– Fe(OH)2 → Fe2O3 dùng CO khử
– Thêm CO2 vào dung dịch Y thu được Al(OH)3 -> Al2O3 sau đó điện phân nóng chảy thu được Al
Hướng dẫn giải
10. Giải bài 23.10 trang 53 SBT Hóa học 12
Hoà tan hiđroxit kim loại M(OH)2 bằng một lượng vừa đủ dung dịch H2SO4 20% thu được dung dịch muối có nồng độ 27,21%. Xác định kim loại M.
Phương pháp giải
– Gọi số mol M(OH)2 là x
– Tính mddsaupư , mmuối
– Từ C% => M
Hướng dẫn giải
Ta có PTHH:
M(OH)2 + H2SO4 → MSO4 + 2H2
x → x → x
m ddH2SO4 = 98x.10/20 = 490x (g)
⟹ mdd sau phản ứng = (M+34)x + 490x = (M + 524)x (gam)
Ta lại có: mMSO4 =(M + 96)x
⟹ C%MSO4= (M+96)x/(M+524)x = 0,2721
⟺ M = 64 Vậy kim loại cần tìm là Cu.
11. Giải bài 23.11 trang 53 SBT Hóa học 12
Nhiệt phân hoàn toàn 9,4 gam một muối nitrat kim loại M hoá trị không đổi được 4 gam oxit và hỗn hợp khí NO2 và O2. Xác định công thức muối của kim loại M.
Phương pháp giải
– Sau khi nhiệt phân thu được oxit kim loại nên loại AgNO3.
– Giả sử kim loại hóa trị II số mol x
– Viết phương trình hóa học, BTKL tính khối lượng khí => x => M của muối=> KL
Hướng dẫn giải
Vì sau khi nhiệt phân thu được oxit kim loại nên loại AgNO3.
Để đơn giản ta giả sử M có hoá trị II :
2M(NO3)2 ⟶ 2MO + 4NO2+ 1/2 O2
x ⟶ 2x ⟶ 1/2x
Nhận thấy khối lượng chất rắn giảm bằng khối lượng khí thoát ra
⟹ mNO2 + mO2 = 9,4 – 4 = 5,4 g
⟶ 46.2x + 16x = 5,4 ⟶ x = 0,05
→MM(NO3)2= 9,4/0,05 = 188
→MM=64
Vậy muối đó là Cu(NO3)2.
==== GIAIBT.COM ====
