I. Liên kết cộng hoá trị không phân cực
1. Sự hình thành phân tử H2

H.+ .H → H : H → H – H → H2
công thức e công thức cấu tạo
* Quy ước:
– Mỗi chấm (–) bên kí hiệu nguyên tố biểu diễn 1 electron ở lớp ngoài cùng.
– Kí hiệu H : H được gọi là công thức electron, thay 2 chấm (:) bằng 1 gạch (–) ta có H–H được gọi là công thức cấu tạo
– Giữa 2 nguyên tử H có 1 cặp electron chung, liên kết biểu thị bằng (–), đó là liên kết đơn.
2. Sự hình thành phân tử N2
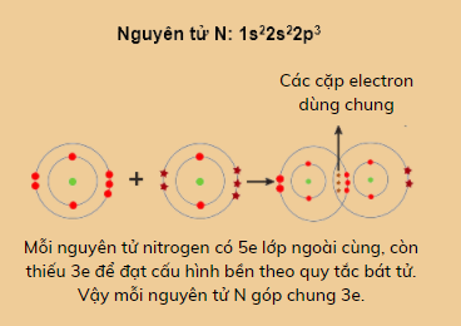
Cấu tạo:
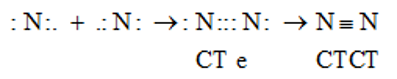
Hai nguyên tử N liên kết với nhau bằng 3 cặp electron liên kết biểu thị bằng 3 gạch (≡) => hình thành liên kết 3.
3. Khái niệm liên kết cộng hóa trị
Định nghĩa: Liên kết cộng hóa trị là liên kết được tạo nên từ 2 nguyên tử bằng 1 hay nhiều cặp electron chung.
– Mỗi cặp electron chung tạo nên 1 liên kết cộng hóa trị, nên ta có liên kết đơn (trong phân tử H2) và liên kết ba (trong phân tử N2)
– Liên kết trong các phân tử H2 và N2 tạo nên từ 2 nguyên tử của cùng 1 nguyên tố (có độ âm điện như nhau), do đó cặp e dùng chung không bị lệch về phía nguyên tử nào, gọi là liên kết cộng hóa trị không phân cực.
Ví dụ: Liên kết trong phân tử F2 là:
A. liên kết kim loại
B. liên kết hidro
C. liên kết cộng hóa trị không phân cực
D. liên kết ion
Lời giải: Liên kết trong phân tử F2 tạo nên từ 2 nguyên tử của cùng 1 nguyên tố Fluorine (có độ âm điện như nhau), do đó cặp e dùng chung không bị lệch về phía nguyên tử nào. Đó là liên kết cộng hóa trị không phân cực.
=> Đáp án: C
II. Liên kết cộng hoá trị phân cực
1. Sự hình thành phân tử HCl
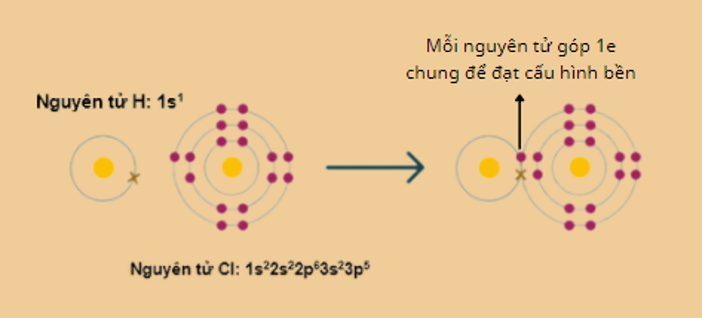
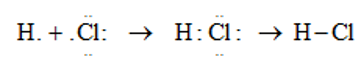
– Cặp e liên kết bị lệch về phía clo (clo có độ âm điện lớn hơn) ( Rightarrow ) liên kết cộng hóa trị bị phân cực.
* Liên kết cộng hoá trị trong đó cặp eletron chung bị lệch về phía 1 nguyên tử (có độ âm điện lớn hơn) gọi là liên kết cộng hoá trị có cực hay liên kết cộng hoá trị phân cực.
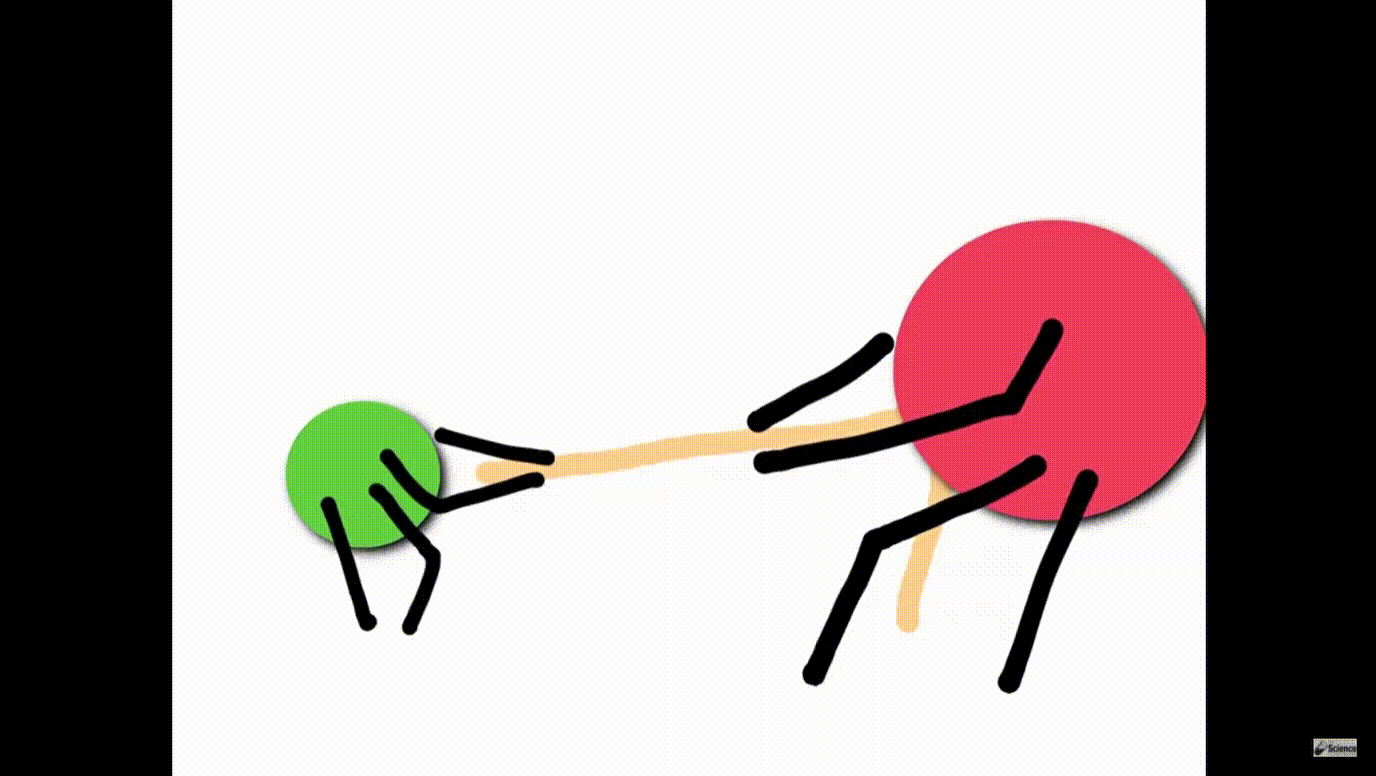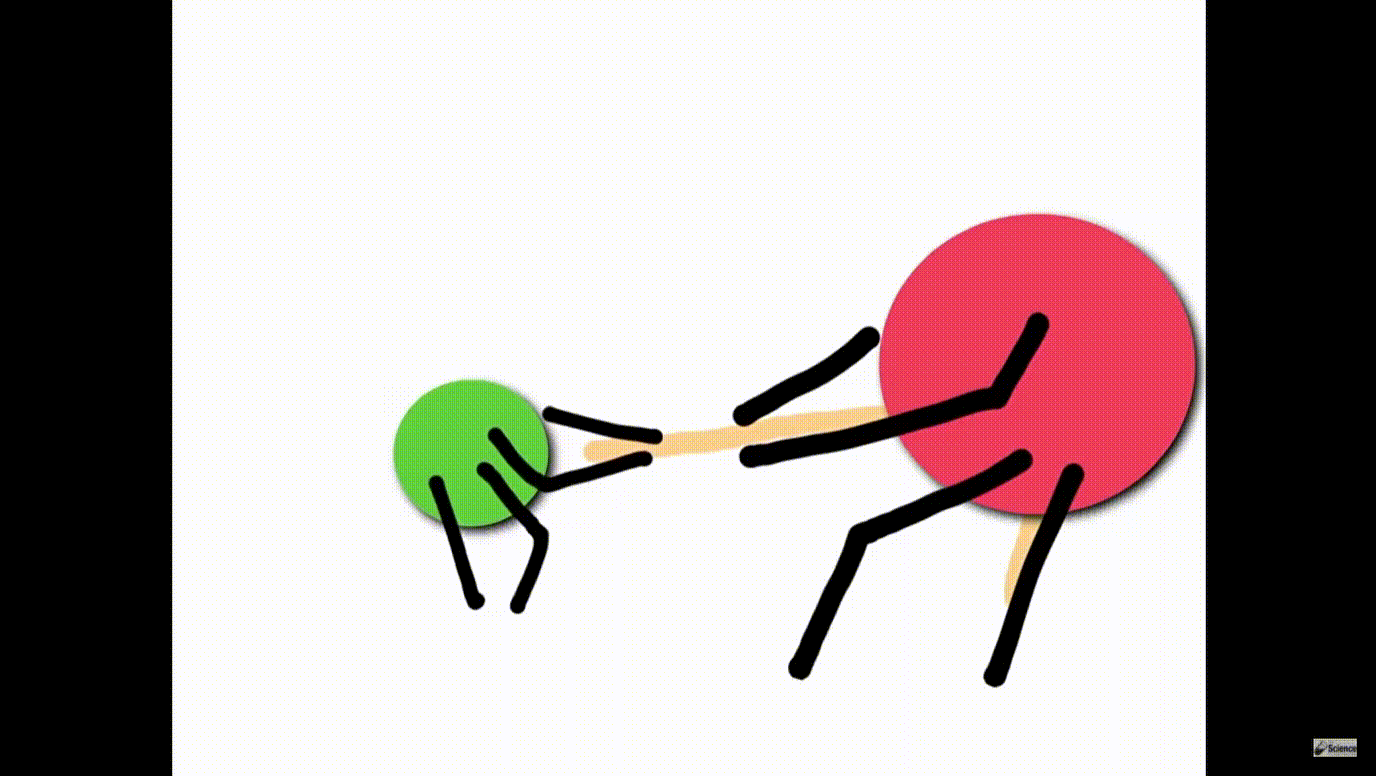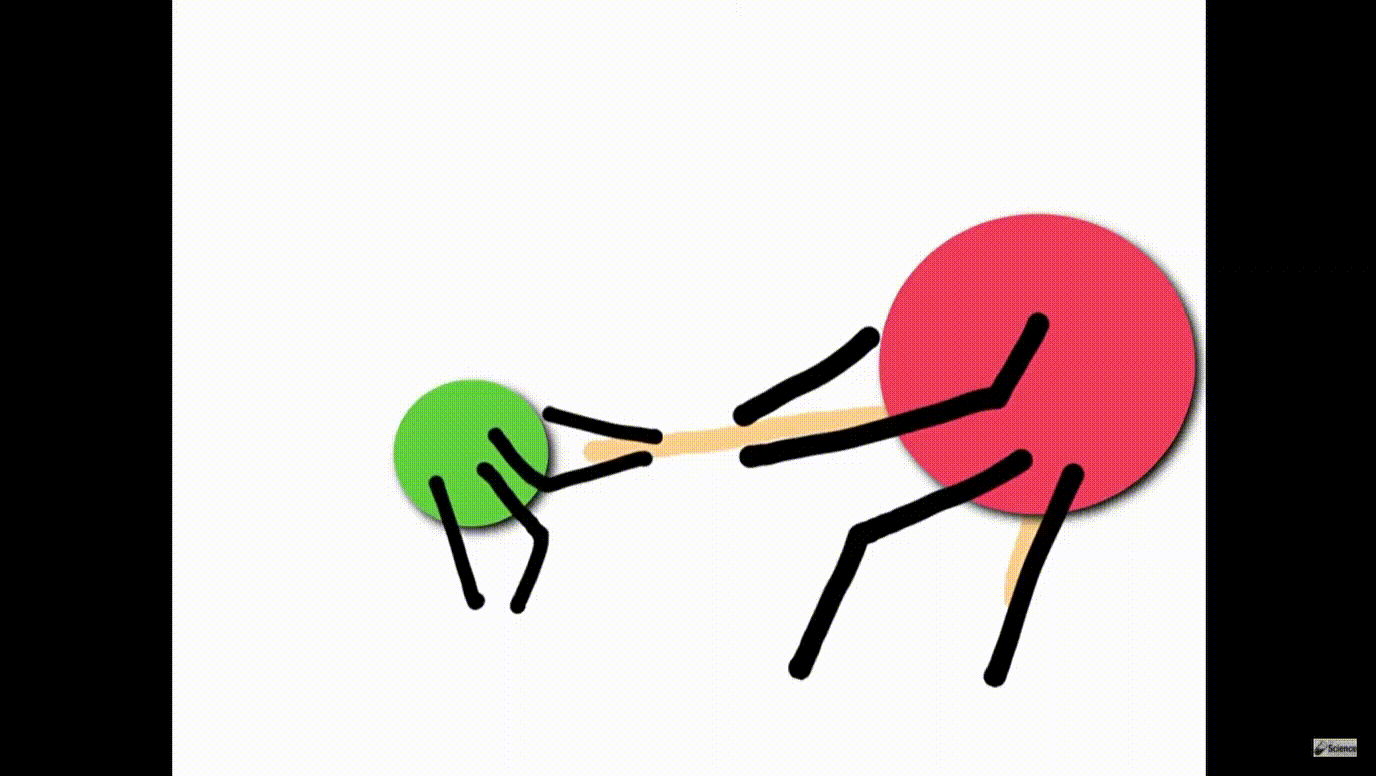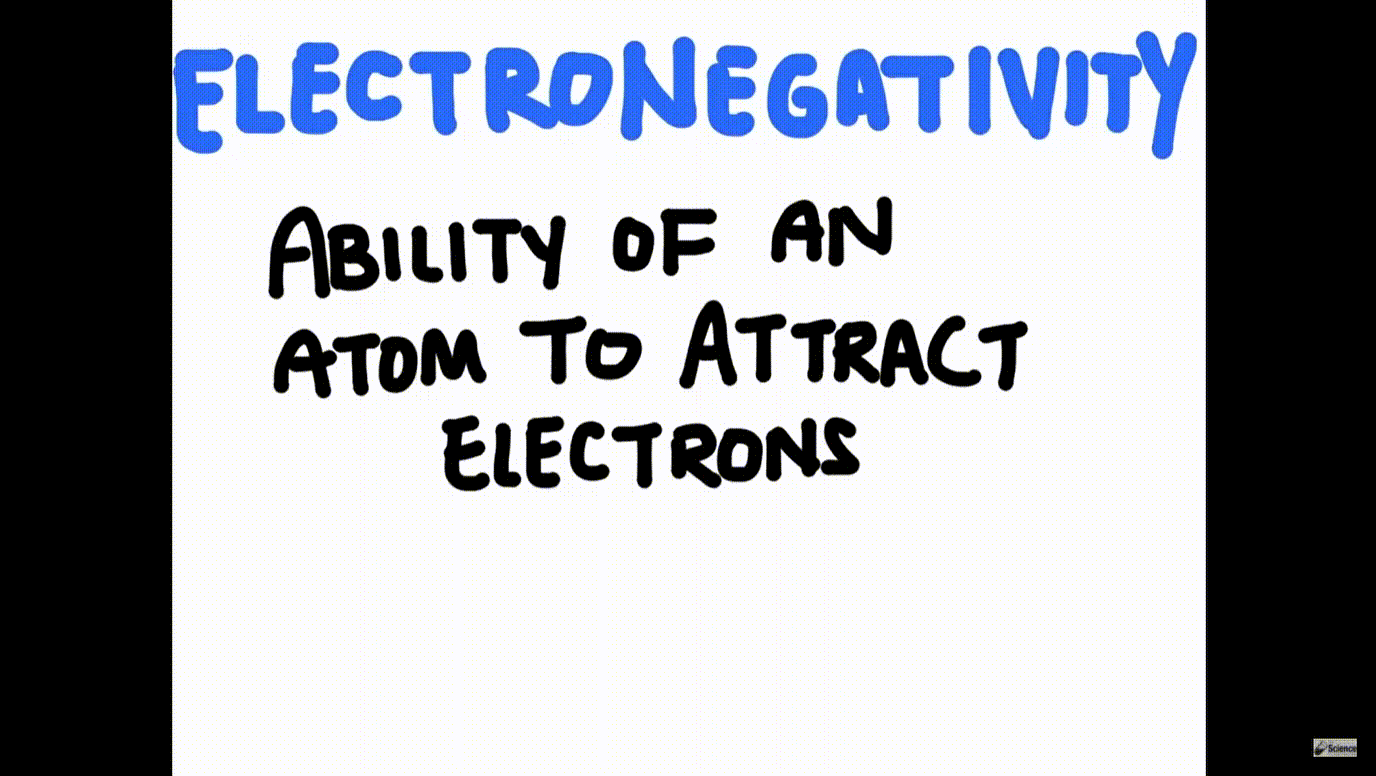
*Trong công thức electron của phân tử có cực, người ta đặt cặp electron chung lệch về phía kí hiệu của nguyên tử có độ âm điện lớn hơn.
2. Sự hình thành phân tử khí cacbonic CO2 (có cấu tạo thẳng)
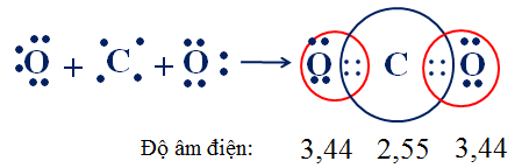
Cấu hình e của C: 1s22s22p2 ( Rightarrow ) thiếu 4e để tạo cấu hình bền ( Rightarrow ) góp chung 4e
Cấu hình e của O: 1s22s22p4 ( Rightarrow ) thiếu 2e để tạo thành cấu hình bền ( Rightarrow ) góp chung 2e
Ta có :
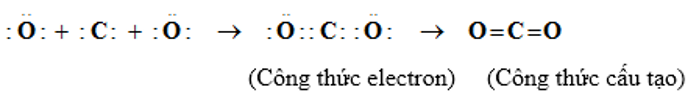
– Theo công thức electron, mỗi nguyên tử C hay O đều có 8e ở lớp ngoài cùng đạt cấu hình của khí hiếm nên phân tử CO2 bền vững.
Cách viết công thức cộng hóa trị:
Bước 1: Xác định cấu hình electron các nguyên tử
Bước 2: Xác định số e thiếu để đạt cấu hình bền của khí hiếm ( Rightarrow ) số e góp chung = số e thiếu
Bước 3: Viết công thức electron thỏa mãn quy tắc bát tử
Ví dụ: Liên kết cộng hóa trị trong phân tử HCl có đặc điểm
A. Có một cặp electron chung, là liên kết ba, có phân cực.
B. Có hai cặp electron chung, là liên kết đôi, không phân cực.
C. Có một cặp electron chung, là liên kết đơn, không phân cực.
D. Có một cặp electron chung, là liên kết đơn, phân cực.
Lời giải:
Cấu hình e của 1H: 1s1 ( Rightarrow ) H có xu hướng nhận thêm 1e để đạt cấu hình bền của He (1s2)
Cấu hình e của 17Cl: 1s22s22p63s23p5 ( Rightarrow ) Cl có xu hướng nhận thêm 1e để đạt cấu hình bền của Ar (1s22s22p63s23p6)
Như vậy H và Cl góp chung 1e để đạt cấu hình bền
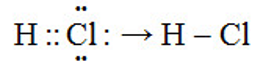
Như vậy liên kết H – Cl có một cặp e chung, là liên kết đơn, phân cực về phía Cl (do Cl có độ âm điện lớn hơn H).
=> Đáp án: D
III. Hiệu độ âm điện – So sánh các loại liên kết hóa học
* Với ∆x là hiệu độ âm điện của 2 nguyên tố ta có:
– Nếu 0 ≤ ∆x < 0,4 thì liên kết được gọi là liên kết cộng hóa trị không cực.
– Nếu 0,4 ≤ ∆x < 1,7 thì liên kết được gọi là liên kết cộng hóa trị có cực.
– Nếu ∆x ≥ 1,7 là liên kết ion
Ví dụ: Xét phân tử HCl có hiệu độ âm điện ∆x = độ âm điện của Cl – độ âm điện của H = 3,16 – 2,2 = 0,96
( Rightarrow ) liên kết giữa H và Cl là liên kết cộng hóa trị có cực.
* So sánh liên kết cộng hóa trị không cực, cộng hóa trị có cực và liên kết ion
– Giống nhau: Các nguyên tử kết hợp với nhau tạo ra mỗi nguyên tử lớp electron ngoài cùng bền bững giống cấu trúc của khí hiếm (quy tắc bát tử).
– Khác nhau:

